 이미지 확대보기
이미지 확대보기기초과학연구원(IBS)은 RNA연구단 김빛내리 단장(서울대 생명과학부 석좌교수) 연구팀이 마이크로RNA(miRNA) 생성과 RNA 치료제에 중요한 핵심 단백질인 '다이서(DICER)'의 핵심 작동원리를 밝혀냈다고 23일 밝혔다. 김 단장은 세계 최고 권위를 가진 학술단체인 영국‘왕립학회’ 소속으로 한국인 최초의 회원이다.
연구팀에 따르면 생명을 구성하는 대표적인 유전물질은 DNA와 RNA. DNA가 유전정보를 담고 있는 설계도라면, RNA는 설계도 원본 중 특정 단백질 생성을 위해 필요한 정보를 전달한다.이중 정확히 어떤 단백질을 만들어야하는지 암호화된 정보를 갖고 있는 게 메신저RNA인데, 이 암호를 푸는 것이 마이크로RNA이다.
miRNA는 약 22개의 뉴클레오티드(핵산을 이루는 단위체)로 구성된 작은 RNA다. 단백질을 만들어내는 메신저RNA(mRNA)와 결합해 특정 유전자의 발현을 선택적으로 억제(조절)해 세포의 증식과 분화, 면역 반응, 노화와 질병 등 생명현상의 모든 과정에 직·간접적으로 영향을 미친다.
인간 몸에 수백 종이 존재하는 miRNA는 재료물질인 기다란 전구체가 '드로셔(DROSHA)' 단백질과 다이서 단백질에 의해 순차적으로 절단되는 독특한 과정을 거쳐 생성된다. 드로셔는 miRNA 1차 전구체(pri-miRNA)를 자르는 절단효소로 miRNA 생합성 과정의 핵심효소다.
이에 따라 miRNA 전구체가 어떻게 절단되는지를 규명하는 것은 생명 현상과 질병을 이해하는 데 매우 중요하다.
이에 앞서 RNA연구단은 지난 2015년 miRNA 생성 효소 중 하나인 드로셔의 기능과 구성을 규명하고 이듬해에는 드로셔의 3차원 구조를 세계 최초로 밝히는데 성공했다.
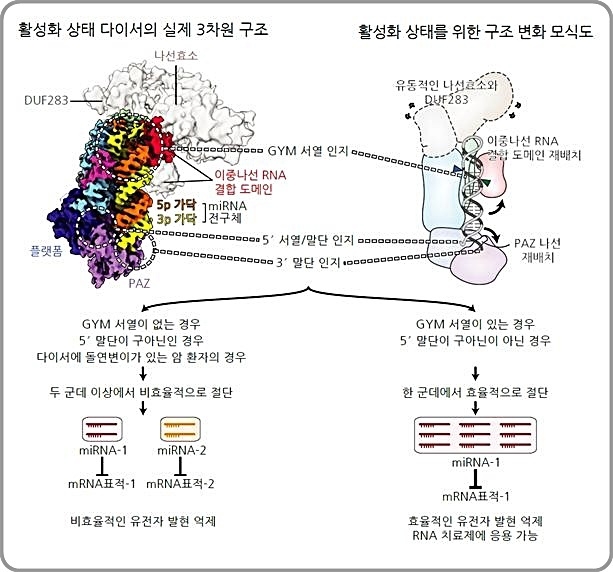
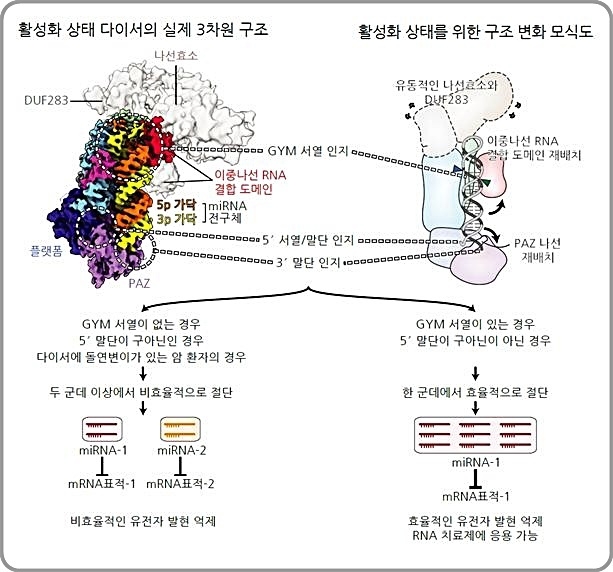
연구진에 따르면 먼저 핵 내에서 RNA 중합효소에 의해 생성된 miRNA 1차 전구체가 드로셔에 의해 절단되고 이로 인해 생성된 miRNA 2차 전구체가 핵 밖으로 나가 세포질에서 다이서에 의해 한 번 더 절단돼 약 22 뉴클레오티드 길이를 가진 miRNA가 된다.
이후 miRNA는 아고넛(Argonaute) 단백질에 장착돼 다른 유전자의 발현을 특이적으로 조절하는 기능을 수행한다.
이번에 연구진은 다이서의 숨은 작동원리를 확인키 위해 RNA를 이루는 4가지 염기인 구아닌(Guanine), 우라실(Uracil), 사이토신(Cytosine) 및 아데닌(Adenine)이 무작위로 구성된 miRNA 전구체를 백만 종 넘게 합성했다.
이어 이 전구체들을 다이서로 한꺼번에 자르고 정량적으로 조사할 수 있는 대규모 병렬 분석법을 적용해 다이서가 전구체를 절단하는데 필요한 서열을 발견하고 miRNA 전구체의 절단 위치를 결정하는데 중요한 역할을 하는 이 서열을 'GYM 서열'이라고 이름 붙였다.
또 기존에 알려진 것처럼 다이서가 드로셔에 의해 만들어진 말단 만을 인지해 절단하는 것이 아니라 miRNA 전구체의 내부 서열을 인지함으로써 스스로 절단 위치를 결정할 수 있다는 것을 밝혀냈다.
특히 RNA 치료기술로 각광받고 있는 'RNA 간섭(RNAi·miRNA)'을 활용해 질병을 일으키는 유전자를 억제하는 기술에 GYM 서열을 적용, GYM 서열이 RNA 간섭 효율을 크게 향상시킬 수 있다는 사실도 규명했다.
GYM 서열을 이용하면 세포 내에서 정확한 miRNA를 다량 생산할 수 있어 유전자를 더욱 효과적으로 제어할 수 있게 된다.
이와 함께 연구진은 노성훈 교수팀과 공동으로 인간 다이서가 miRNA 전구체를 자르는 순간을 포착, 다이서-miRNA 전구체의 3차원 구조를 높은 해상도에서 관찰하는 데도 성공했다.
 이미지 확대보기
이미지 확대보기◇"생명과학계 20여년 간 베일에 싸였던 난제 중 하나 풀어"
인간 다이서 단백질의 3차원 구조는 지난 20여 년간 세계 여러 연구진의 노력에도 풀리지 않았으나 IBS와 서울대의 첨단 초저온전자현미경의 활용을 통해 세계 최초로 활성화된 상태의 구조를 규명해 냈다.
연구팀은 이 3차원 구조를 통해 다이서가 어떻게 miRNA 전구체를 인지하는지, 어떤 서열이 다이서와의 결합에 중요한지를 밝혀내 효과적인 RNA 치료제 개발에 큰 힘을 싣게 됐다.
또 공동 연구팀은 일부 암 환자들에게 다이서의 특정 부분에 돌연변이가 발생하는 것을 발견하고 이 돌연변이가 생기면 miRNA 전구체를 제대로 인지하지 못해 miRNA 생성에 심각한 문제가 생긴다는 것을 확인했다.
김빛내리 단장은 "miRNA 생성과정을 이해하면 질병의 발병 원인을 파악하는 데 도움이 되고 RNA 간섭 효율을 높여 유전자 치료기술을 발전시킬 수 있다"며 "장기간 연속성 있게 연구할 수 있는 환경속에서 창출한 이번 연구결과로 miRNA 생성과정에 대한 이해를 한층 확장하고 국제적인 경쟁력을 이어갈 수 있게 됐다"고 말했다.
한편 김 단장은 지난 2012년 IBS RNA 연구단장으로 부임해 RNA와 유전자 조절을 연구 중이다. 전령RNA의 분해를 막는 '혼합 꼬리'를 발견해 2018년 '사이언스'에 발표했고, 코로나19의 원인인 코로나바이러스의 RNA 전사체를 세계 최초로 분석해 지난해 '셀'에 발표하는 등 독보적 성과를 창출한 RNA 분야 세계적 석학이다.
이를 국내외에서 인정받아 지난 2010년 국가과학자, 2013년 유럽분자생물학기구 외국인 회원, 2014년 미국국립과학원(NAS) 외국인 회원, 2014년 한국과학기술한림원 정회원으로 선정됐다.
김성원 글로벌이코노믹 기자 winner5858@g-enews.com