 이미지 확대보기
이미지 확대보기이번에 신청한 IND는 진행성 또는 전이성 고형암 환자를 대상으로 HM16390의 안전성과 내약성, 약동학, 약력학 특성 등을 평가하는 내용의 임상시험계획이다.
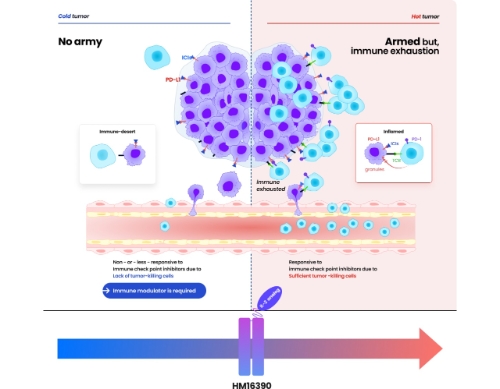
이 파이프라인은 항암 약물 치료 주기당 1회 피하 투여가 가능한 지속형 제제로 기존의 IL-2 제제와는 차별화된 수용체 결합력을 통해 항암 효능이 크게 향상됐다. 흑색종과 대장암뿐 아니라신장암과 췌장선암의 동물모델 등에서 확인된 우수한 효능을 바탕으로 다양한 진행성 또는 전이성 고형암에서 치료 효능을 보여줄 것으로 기대된다.
또한 면역관문 억제제에 반응을 보이지 않는 '차가운 종양'에서도 치료 효과를 이끌어낼 수 있는 중요한 치료 옵션이 될 것으로 기대된다.
한미약품 관계자는 "항종양 효능 극대화와 함께 안전성까지 개선된 HM16390은단독요법은 물론 면역관문 억제제 병용시 종양미세환경을 변화시켜 치료 효과를 크게 높일 수 있을 것으로 기대된다"며 "기존 치료제에 반응하지 않는 암 환자에게 대안이 되는 차세대 면역조절 항암제 개발을 완수할 수 있도록 연구에더욱 매진하겠다"고 말했다.
한편 HM16390은 2022년 9월 국가신약개발 과제로도 선정된 바 있다. 국가신약개발 사업은 정부가미충족 의료 수요가 높은 분야의 치료제 개발을 촉진하기 위해 제약바이오 기업과 학교, 연구소, 병원 등의 신약개발을 지원하는 국가 R&D 지원 사업이다.
이재현 글로벌이코노믹 기자 kiscezyr@g-enews.com

















![[단독] 삼성웰스토리, 베트남서 5억대 세금추징 ‘망신’](https://nimage.g-enews.com/phpwas/restmb_setimgmake.php?w=184&h=118&m=1&simg=20241123122843083909a1f3094311109215171.jpg)











































