 이미지 확대보기
이미지 확대보기한미약품은 지난 3일(미국 현지시각) 미국 식품의약국(FDA)으로부터 차세대 비만 치료 삼중작용제 HM15275의 임상1상 진입을 위한 임상시험계획(IND)을 승인 받았다고 7일 밝혔다.
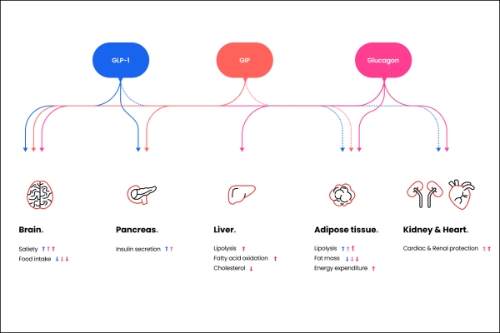
HM15275는 현재 임상 3상 개발이 진행 중인 '에페글레나타이드'의 혁신을 이어나갈 차세대 비만 신약으로, 글루카곤 유사 펩타이드(GLP-1)와 위 억제 펩타이드(GIP), 글루카곤(GCG) 등 각각의 수용체 작용을 최적화해 비만 치료에 특화됐으며 부수적으로 다양한 대사성 질환에 효력을 볼 수 있도록 설계된 것이 특징이다.
이 세 가지 약리작용을 적절히 활용하면 비만뿐 아니라 제2형 당뇨병 및 심혈관 질환에 대한 치료 잠재력을 극대화할 수 있다는 게 한미약품 설명이다.
한미약품은 오는 6월 미국에서 열리는 2024 미국당뇨병학회(ADA)에서 HM15275에 대한 4건의 비임상 연구 결과를 발표할 예정이다.
이 학회에서 한미약품은 비만 모델에서 체중감량 효능에 대한 HM15275의 계열 내 최고신약 잠재력 및 그 작용 기전을 규명한 결과를 공개한다. 또한 비만이 주요 원인이라고 알려진 다양한 심혈관계 질환 모델에서 HM15275의 차별화된 치료 효능을 입증한 결과를 발표한다.
한미약품은 HM15275가 우수한 체중감량 효능은 물론, 심혈관 및 신장 질환에 대한 개선 효과를 나타내는 '차세대 비만치료제'가 될 것으로 기대하고 있다.
최인영 한미약품 R&D센터장은 "HM15275에는 한미가 인크레틴 분야에서 20년 이상 연구를 지속하면서 축적한 연구 지식과 노하우들이 집약됐다"며 "전 세계적 사회 문제로 대두되고 있는 비만영역에서 치료 효과를 혁신적으로 높인 차세대 신약 개발을 완수할 수 있도록 연구에 더욱 매진하겠다"고 말했다.
이재현 글로벌이코노믹 기자 kiscezyr@g-enews.com



































![[NY 인사이트] AI 폭발 수혜 주목해야 할 데이터센터 관련주 TO...](https://nimage.g-enews.com/phpwas/restmb_setimgmake.php?w=80&h=60&m=1&simg=2024112404454903154e250e8e1885822911040.jpg)

























