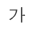 이미지 확대보기
이미지 확대보기이번 발표는 코오롱생명과학[102940]의 미국 자회사 코오롱티슈진[950160]에 대한 현지 실사와 자체 조사 결과 등을 토대로 한 것이다.
코오롱 측은 인보사의 일부 성분이 개발 도중 바뀐 게 아니라 개발 초기부터 상업화에 이르기까지 동일한 신장세포(293유래세포)가 사용됐다고 주장해왔다.
인보사는 사람 연골세포(HC)가 담긴 1액과 연골세포 성장인자(TGF-β1)를 도입한 형질전환세포(TC)가 담긴 2액으로 구성된 골관절염 유전자치료제 주사액이다.
그 2액의 형질전환세포가 허가 당시 제출한 자료에 기재된 연골세포가 아닌 신장세포로 드러나 논란이 일고 있다.
코오롱티슈진은 영문으로 'Kolon TissueGene, Inc.' 로 표기한다. 1999년 6월 9일 설립되었다.
본사 소재지는 9605 Medical Center Dr. Suite 200, Rockville, MD 20850, USA이다.
코오롱 티슈진이 공시한 사업 내용은 인대손상치료, 연골재생촉진제의 연구, 개발, 생산, 판매 및 생명공학 분야 연구, 개발, 생산, 투자이다.
주력 개발품목인 INVOSSA는 골관절염 세계 최초 세포 유전자 치료제이다.
그동안 미국에서 임상을 진행해 왔다.
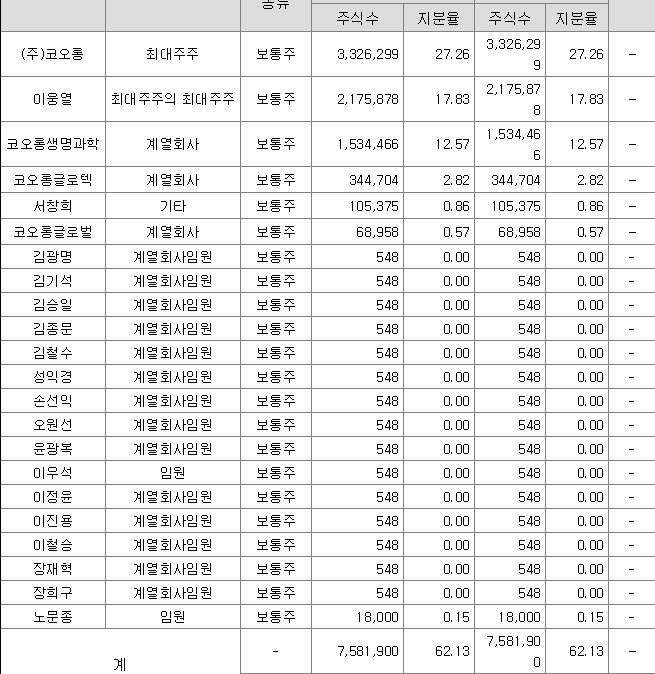
코오롱티슈진의 최대주주는 (주)코오롱이다.
독점규제 및 공정거래에 관한 법률상 코오롱그룹에 속한 계열회사다. 이 코오롱그룹에는 당사를 포함한 국내 41개 계열회사와 해외 35개 계열회사가 소속되어 있다.
[국내법인]
건설 유가증권시장상장 = 코오롱글로벌㈜
비상장 = ㈜테크비전
금융 비상장= ㈜코오롱인베스트먼트
서비스 유가증권시장상장= ㈜코오롱
비상장 =덕평랜드㈜, 명지에너지㈜, 코오롱하우스비전㈜, 리베토코리아㈜, 양양풍력발전㈜, 코오롱환경서비스㈜, 그린나래㈜, ㈜엠오디, 코오롱엘에스아이㈜, 코오롱베니트㈜, 코오롱에코원㈜, 더블유파트너스㈜, 이노베이스㈜, 코오롱에코너지㈜, 코오롱이엔지니어링㈜, 네이처브리지㈜, 천안북부일반산업단지㈜, 코오롱오토케어서비스㈜
유통 비상장=코오롱아우토㈜, 코오롱오토모티브㈜, 코오롱오토플랫폼㈜, 스위트밀㈜
제조 유가증권시장상장=코오롱인더스트리㈜, 코오롱플라스틱㈜, 코오롱패션머티리얼㈜
코스닥상장=코오롱생명과학㈜
비상장=코오롱제약㈜, 코오롱글로텍㈜, ㈜케이에프엔티, ㈜셀빅개발, 케이에이치파워㈜, 코오롱하이드로제닉스㈜, 코오롱바스프이노폼㈜, ㈜씨에이텍, 아토메탈테크코리아㈜, 코오롱데크컴퍼지트㈜, 데크씨에스피㈜
코오롱티슈진은 미국 델라웨어 주법에 따라 설립된 회사다.
사업 부문은 무릎 골관절염 치료제를 개발하는 바이오사업 부문과 더마코스메틱 브랜드를 제조·판매하는 화장품사업 부문 및 헬스&뷰티 상품의 유통을 담당하는 복합유통사업부문으로 구분된다.
당사는 1999년 6월 9일 세포 유전자 기술 Platform을 이용한 골관절염 치료제를 개발하기 위해 설립되었습니다. 2004년 9월 "TGF-β1을 이용한 유전자치료"로 미국 특허 등록을 획득하였으며, 당사의 무릎 관절염 치료제인 INVOSSA는 아시아 판권을 보유한 코오롱생명과학이 한국 임상 3상을 종료하고, 2017년 7월 12일 식품의약품안전처에 국내 품목허가를 획득하였습니다. 당사는 2015년 5월 미국 FDA로부터 임상시험계획 심사 절차인 SPA(Special Protocol Assessment) 동의를 획득하였습니다. SPA 승인 획득 당시에는 준비 중이던 임상시료는 생산완료해 임상 시료의 사용에 대해 FDA로부터 승인을 받았으며 2018년 11월, 임상 3상의 첫 환자을 기점으로 투약이 진행되고 있습니다. 그러나 공시작성 기준일 현재, INVOSSA의 구성성분 중 하나인 제2액이 회사가 지금까지 인지하여 온대로 연골유래세포가 아닌 신장유래세포임을 발견하면서 투약을 잠정 중단하였습니다. 미국 FDA로부터 임상을 계속 진행하여도 좋다는 승인을 받는 대로 임상을 가속화 할 계획입니다. 임상 3상은 2022년까지 완료해 2022년 중 BLA신청, 2023년 중 BLA 승인을 받아 본격적인 신약의 판매를 개시하는 일정을 계획하고 있으나 투약을 중단한 기간만큼 지연될 것으로 예상하고 있습니다.
또한, 당사의 사업부문으로는 화장품사업부문과 복합유통사업부문이 있습니다. 당사의 화장품사업부문에서는 2016년 10월 홍콩을 시작으로 더마코스메틱 브랜드 위즈더마(WISDERMA)를 론칭하였고, 공시서류 작성 기준일 이후 브랜드 리뉴얼을 진행해 기초화장품 6품목을 판매하고 있습니다. 복합유통사업부문은 헬스&뷰티 상품(건강기능식품,화장품, 생활용품, 식품 등)을 판매하는 드럭스토어 체인 w-store 브랜드를 2004년부터 운영하고 있으며, 매입 상품 뿐만 아니라 자사 PB제품을 개발하여 직영점, 가맹점, 온라인 등 기타 채널에 공급하고 있습니다.
가. 산업의 개요
[바이오사업부문]
(1) 산업의 개요
(가) 제약 및 신약개발 산업
일반적으로 제약산업은 하나의 제품이 시판되어 매출을 생성할 때까지 아래와 같은 과정을 거치게 됩니다. 의약품 개발은 인체와도 직결되는 분야이므로 규제가 복잡하고 연구개발과정에 시간과 비용이 많이 소요됩니다. 특히, 임상개발단계에서는 천문학적인 비용이 발생할 수 있습니다.
신약개발 과정 및 개발 구조ㆍ형태 개요
이미지: 사업의내용_신약개발과정및개발구조
사업의내용_신약개발과정및개발구조
과거 글로벌제약 산업은 기초연구, 개발, 제조, 판매/마케팅 등 모든 기능을 갖춘(fully-integrated) 대형 제약사들을 중심으로 신약개발이 이루어졌으나, 국가별 의료비 보상정책 등 약가 및 의료정책의 변화, 규제허가기준의 강화 등 여러 요인에 의하여 신약개발업체들이 개발 기능 중심의 최소 규모를 유지하고 임상시험 수행, 생산, 영업 등은 외부 전문업체에게 위탁하는 방향으로 변화하고 있습니다. 당사는 공시서류 작성 기준일 현재 INVOSSA의 성공적인 상업화 이후 세포유전자치료제 기반기술을 활용한 적응증 추가 및 동물관절염 시장 진입 등을 목표로 연구개발에 주력하고 있습니다.
(나) 골관절염 치료제 산업
골관절염은 통증 및 기능성 장애로 인해 일상생활에 장애를 초래할 뿐만 아니라 육체적 및 정신적 문제를 야기하는 질환으로, 만성적 염증 기전의 악순환에 의해 진행되며 주로 통증과 관절기능 저하가 나타납니다. 골관절염은 무릎관절, 어깨, 고관절, 손가락 마디 등에서 발생하며, 골관절염은 주로 60세 이상의 연령에서 발병하는 질환입니다.
골관절염 관절구조
이미지: 사업의내용- 골관절염
사업의내용-골관절염
골관절염은 질환의 정도에 따라 치료법이 나뉩니다. K&L 1등급의 경증 환자는 생활습관 교정이나 물리치료, 일반의약품 등을 이용한 치료를 받고 있는 반면, 중등도(K&L 2-3 등급)의 환자는 전문의약품(비스테로이드성 소염제 등) 혹은 히알루론산 관절주사, 스테로이드 주사 등을 통해 치료받고 있으며 중증 환자(K&L 4등급)은 이에 더하여 마약성 진통제나 인공관절치료, 연골이식, 반월상연골절제술 등의 수술적 치료법으로 치료받고 있습니다.
당사의 INVOSSA는 중기 이후의 환자 (K&L 등급 2~3기)를 대상으로 치료를 시행해 병증을 완화하고 인공 관절 등 수술적 치료법의 시점을 미룰 수 있는 효과를 기대하고 있습니다.
무릎 골관절염의 치료 패러다임
이미지: 사업의내용-무릎골관절염의치료패러다임
사업의내용-무릎골관절염의치료패러다임
(2) 산업의 특성
(가) 제약 및 신약개발 산업의 특성
1) 철저한 규제 의존성
새로운 의약품이 환자에게 판매되기 위해서는 신약후보물질의 발굴에서부터 동물을 대상으로 하는 전임상 시험, 인체를 대상으로 하는 임상시험, 시판승인이라는 각 단계를 모두 거쳐야 하며 모든 단계에서 각 국가의 규제당국이 제시하는 규정을 모두 준수해야 합니다.
특히 인체를 그 시험대상으로 하는 임상시험을 진행하고자 할 때에는 효능과 안전성에 대한 각 국가의 정부규제가 엄격해 인체에 대한 임상시험 이전 단계부터 엄격한 규제에 의해 축적된 다양한 데이터를 각 국가의 규제당국에 제출하여야 합니다. 또한 임상개시를 허용받고 임상시험을 진행 중인 경우에도 심각한 부작용 등이 보고되는 경우에는 진행 중인 임상이 규제당국에 의해 중단되거나 철회될 수 있습니다.
또한, 임상시험을 성공적으로 마치고 시판승인을 받은 신약을 생산 및 판매하는 과정에서도 규제당국이 제시하는 엄격한 규정을 따라야 합니다.
FDA의 신약 개발 승인 과정
이미지: 사업의내용-FDA의 신약개발승인과정
사업의내용-FDA의 신약개발승인과정
자료: US FDA (Food and Drug Administration)
다만, 개발중인 신약의 안정성이 일정 수준 이상 확인되고 그 의학적 효능이 기존 치료제 대비 월등하거나 희귀질환을 치료할 수 있는 경우에는 전체 규정된 임상단계가 완료되지 않은 단계에서도 조건부 혹은 전면 조기시판승인이 허용되기도 합니다.
2) 높은 진입장벽
신약후보물질이 초기 연구 및 임상시험을 거쳐 시판승인을 이루기까지는 짧게는 수년에서 길게는 15년 이상의 기간이 소요되며 그 과정에서 많은 개발비용이 발생하게 됩니다.
즉, 제약 및 신약 개발산업은 높은 개발비용에 따른 진입 장벽이 존재합니다.
조사결과에 따르면 신약개발 과정에서 발생하는 개발비용은 지속적으로 증가하는 추세를 보이고 있습니다. 1970년대의 경우 시판된 신약에 대한 연구개발 비용이 1억8000만 달러(약 2100억 원) 수준으로 나타났으나 2010년에 들어와서는 2억5580만 달러(약 3조 원)에 달하는 것으로 조사되었습니다. 이는 신약의 성공 확률이 과거 대비 하락하고 있어 시판에 성공하는 신약 당 연구개발 비용의 증가세가 두드러지는 것으로 이해되며, 결과적으로 신약개발에 따른 진입장벽이 갈수록 높아지고 있는 추세를 보이고 있는 것으로 파악됩니다.
시판된신약의연구개발비용
(단위: 백만 달러)
이미지: 사업의내용_시판된신약의연구개발비용
사업의내용_시판된신약의연구개발비용
자료: 1970s, Hansen(1979), 1980s, DiMasi et al.(1991); 1990s-early 2000s, DiMasi et al.(2003); 2000s-early 2010s, Current Study; Tufts Center for the Study of Drug Development
주) 신약개발에 소요되는 직간접비 포함
오랜 기간에 걸쳐 개발된 신약은 통상적으로 특허권에 의해 일정기간 동안 그 권리를 보호받게 되며, 희귀질환 치료제의 경우 신약개발의 인센티브를 부여하기 위하여 규제당국으로부터 시판승인 후 일정기간 동안 독점판매기간을 허용 받을 수도 있습니다.
대부분의 국가에서 특허 존속기간은 출원 후 20년이고, 해당 신약이 최초로 개발된 생물학적 제제 (reference drug)로 지정되는 경우에는 특허 존속기간과 관계없이 미국은 시판 승인후 12년, 유럽은 10년간 독점판매권을 보장받기 때문에 해당 기간 동안 유사한 효능을 가지는 신약이나 복제약이 시장진입을 하기 힘든 구조입니다.
김대호 기자 tiger8280@g-enews.com